Autoři
Susanne I. Schmidt, Vít Kodeš, Miroslava Svátková, Petr Blabolil
Klíčová slova
podzemní voda – podzemní živočichové – potravní síť – hydrogeochemie – biogeografie – živiny – uhlík
Studium organismů podzemních vod je poměrně opomíjenou oblastí zájmu i v České republice. Živočišstvo podzemních vod se přitom živí mikroorganismy a přispívá tak k čištění podzemních vod od organických látek, čímž plní zásadní ekosystémové služby. Přítomnost těchto živočichů ve zvodnělých hydrogeologických vrstvách má velký význam pro tvorbu jakostní pitné vody. V literatuře doposud prakticky schází informace o vlivu změn klimatu na podzemní živočichy. Z těchto důvodů jsme začali sledovat společenstva bezobratlých živočichů podzemních vod ve vrtech státní pozorovací sítě podzemních vod Českého hydrometeorologického ústavu (ČHMÚ) v jižních Čechách a v oblasti u Sokolova. Zde předkládáme první výsledky, které budou podkladem pro výběr míst nadcházejících sledování. I když jsme živočichy určovali jen do vyšších taxonomických úrovní, zjištěné ekologické vztahy jsou zjevné. Nízké koncentrace rozpuštěného kyslíku nejsou pro podzemní živočichy limitující, na rozdíl od organického uhlíku. Výskyt bezobratlých živočichů byl nejvyšší v místech s nejvyšší koncentrací organického uhlíku. Vztahy se živinami mohou naznačovat, jaké děje se odehrávají pod povrchem země i jaký je přísun látek z povrchu. Nadcházející výzkum bude zaměřen na provedení opakovaných odběrů ze stejných lokalit, na základě čehož budeme moci vyhodnotit proměnlivost výskytu živočichů v podzemních vodách.
Úvod
Historie
Ekologické studie podzemních systémů jsou obvykle zanedbávány, protože do podzemí není vidět, a máme tak jen mlhavé představy o probíhajících procesech a jejich významu. Ekosystémy podzemních vod však mohou být stejně fascinující jako hluboká moře, kde jsou zastoupeny fylogeneticky prastaré organismy, které se přizpůsobily svému prostředí, mezi nimiž je mnoho endemitů (druhy, které se vyskytují pouze v geograficky omezené oblasti). Podzemní vody jsou domovem předků a přechodných forem současných druhů organismů, čímž lze získávat informace i o vývoji druhů na Zemi. Příležitostná pozorování ukazují, že v podzemních vodách jsou přítomni charismatičtí živočichové, jako slepé jeskynní ryby, například jeskyňovka yucatánská (Typhliasina pearsei) v Mexiku [1], či druh mřenky (Barbatula sp.) objevený teprve v roce 2015 v systému Dunaj–Aach [2], nebo z obojživelníků macarát jeskynní (Proteus anguinus) obývající jeskyně u pobřeží Jaderského moře [3]. Za zakladatele moderní ekologie podzemních vod je považován prof. František Vejdovský [4, 5]. Mezi nejvýznamnější objevy prof. Vejdovského patří popsání rodu korýšů bezkrunýřek (Bathynella) z pražských studní. Zástupci tohoto rodu jsou dnes známi z oblastí po celém světě a zahrnují téměř výlučně podzemní druhy, z nichž jsou některé využívány jako citlivé ekologické indikátory [6]. Po prvních výzkumech na území Čech v 19. století se těžiště výzkumu ekologie podzemních vod přesunulo do jiných částí světa [7, 8, 9] a poznatky o české podzemní vodě jsou omezeny pouze na několik málo vzorků (např. [10, 11, 12]). V současné době jsme znovu začali navazovat na dědictví Vejdovského a vzorkujeme živočichy ve vrtech monitorovaných Českým hydrometeorologickým ústavem (ČHMÚ). Díky desetiletím odběrů vzorků ČHMÚ jsou k dispozici údaje o geologických a hydrogeochemických charakteristikách, a máme tak k dispozici dobrý materiál pro ekologické studie podzemních vod.
Ekosystém ohrožený změnou klimatu
Ekosystémy podzemních vod jsou charakterizovány relativní stabilitou. Teplotní změny a všechny ostatní vlivy z povrchu jsou s rostoucí hloubkou a vzdáleností od povrchu postupně tlumeny. Avšak dlouhodobé změny klimatu na povrchu země se promítají i pod její povrch, a může tak dojít ke změnám diverzity a struktury potravní sítě podzemních vod [13], chování živočichů [14] a následně ekosystémových služeb. Těmito službami zde uvažujeme čištění vody přinášející užitek lidské společnosti, na které má pozitivní vliv aktivita zkoumaných podzemních bezobratlých živočichů. Když dojde k negativnímu ovlivnění fauny ve vodonosné vrstvě (tj. v geologickém či půdním útvaru, kterým voda protéká), příslušné ekosystémové služby přestávají fungovat, a toto narušení trvá až do doby, kdy vodonosnou vrstvu osídlí odolnější druhy, což může být dlouhodobý proces. Vstup nových odolnějších druhů je navíc zpomalován různými mechanismy, jako je například efekt uvolnění niky [15].
Organismy podzemních vod
Mezi organismy podzemních vod, které obývají porézní a popraskané horniny kolektorů, patří bakterie, archea, houby, prvoci a živočichové, jako jsou hlístice, máloštětinatci, mnohoštětinatci, želvušky, roztoči a korýši (převážně různonožci, klanonožci a stejnonožci – zejména beruškovití). Rostliny a další organismy, které vyžadují energii ze slunečního záření, v podpovrchových systémech nežijí. Obecně jsou v podzemních vodách zastoupeny téměř všechny živočišné kmeny, zejména pokud zahrneme jeskynní podzemní vody. Větší živočichové, jako jsou obojživelníci a ryby, vyžadují „krasové prostory“, které lze nalézt výhradně v jeskyních. U některých skupin, např. členovců, se v podzemních vodách vyskytují druhy s odlišnou morfologií oproti druhům přizpůsobeným životu na povrchu země. Lze je tedy snadno odlišit od povrchové fauny, i v případě, kdy se identifikace druhů jeví jako obtížná. Stejně jako u mnoha jiných stanovišť v současné době nabývá na významu identifikace druhů pomocí moderních molekulárních technik, jako je sekvenace DNA [16].
Podzemní organismy přispívají k čistotě vody
Důležitější než druhová či tvarová rozmanitost, biogeografické rozšíření či schopnost přežít v omezeném prostředí je příspěvek organismů podzemních vod k samočisticí funkci vod. Tyto organismy tak poskytují zásadní ekosystémové služby [17] tím, že rozkládají organickou kontaminaci (přirozený útlum; [18]). Fauna podzemních vod dále přispívá k rozkladu požíráním mikroorganismů a současně udržuje volnou pórovitou strukturu vodonosných vrstev (bioturbace; [19]). Variabilita prostoru vede ke zvýšené variabilitě průtoku, což má za následek vyšší okysličování podzemní vody [19]. Celkově podzemní organismy přispívají k vysoké kvalitě vody pro tvorbu pitné vody [20].
Podzemní voda jako zdroj pitné vody
Celosvětově podzemní voda představuje polovinu zdrojů pitné vody [21]. Česká republika zabezpečuje zhruba 48 % pitné vody přímo z podzemních vod a 52 % z toků a nádrží [22]. Započítání domovních studní pro individuální zásobování obyvatelstva – dle Českého statistického úřadu 5,3 % obyvatel není zásobováno z veřejných vodovodů [23] – může tento poměr převážit na stranu podzemních zdrojů. V porovnání s velkými povrchovými vodními zdroji (řeky a nádrže) je v některých oblastech výrazně více vody uloženo v podzemí. Praha s 1,25 mil. obyvatel mimo jiné spoléhá od šedesátých let 20. století na umělé doplňování podzemní vody pro čtvrtinu distribuované pitné vody [24] a umělá infiltrace nabývá stále na důležitosti. Změna klimatu by mohla způsobit snížení jakosti surové vody z povrchových zdrojů (například v období sucha, toxické vodní květy), čímž by se zvýšil význam zdrojů podpovrchových. Aktuální výzkumy varují před zvýšenou intenzitou výskytu toxických vodních květů [25] a takzvaným hnědnutím vod [26, 27], které jsou spojovány se změnou klimatu. Rovněž povrchové vody jsou obvykle částečně spjaty s podpovrchovými vodami a jejich jakost tedy ovlivňuje kvalitu vod v řekách, jezerech a nádržích [28].
Příležitosti k výzkumu
Kvalita podzemní vody není dána pouze kvalitou infiltrující vody, hydrogeologickým prostředím a podnebím, ale také ekosystémovými službami živočichů. Podmínky, za nichž ekosystém podzemních vod poskytuje ekosystémové samočisticí služby, doposud nejsou dopodrobna známy. Stejně jako opylení hmyzem (klíčové pro většinu produkce ovoce a zeleniny) je i tato ekosystémová služba obvykle považována za samozřejmost. Ovšem stejně jako opylení, přirozené samočištění podzemní vody je ohroženo změnou klimatu a zvyšující se kontaminací rozličnými látkami. Změny teploty podzemní vody mění rozmanitost a složení potravního řetězce podzemních vod [13], chování živočichů [14] a následně plnění ekosystémových služeb.
Toky energie v potravní síti
Hlavním zdrojem energie pro organismy podzemních vod je rozkládaná půdní organická hmota. Většina těchto látek je v půdě transformována na oxid uhličitý (CO2) a metan (CH4) [29]. Zbývající sloučeniny se spolu s živinami rozpouštějí do podzemní vody [30] a jsou heterotrofně degradovány mikroorganismy (bakterie, archea, houby). Předpokládá se, že mikroorganismy jsou hlavním zdrojem potravy pro živočichy podzemních vod (schéma potravní sítě na obrázku 1). Živočichové jejich konzumací omlazují mikrobiální společenstvo a tím podporují bakteriální přeměny [17]. To zvyšuje celkový rozkladný potenciál zvodnělé vrstvy. Čím více organického uhlíku pronikne do podzemních vod, např. v důsledku antropogenního znečištění na povrchu, tím významnější je degradace mikroorganismy, a důležitější se stává role živočichů.
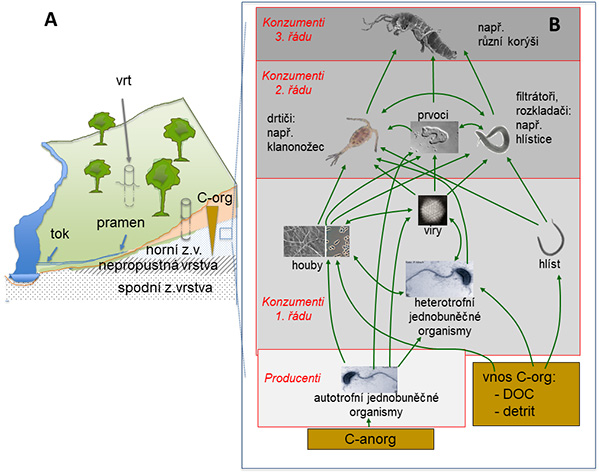
Obr. 1. Struktura potravní sítě podzemních vod. A: Průřez krajinou. Z.v. = Zvodnělá vrstva: horniny kolektoru podzemních vod; nepropustná vrstva: vrstva nepropouštějící vodu (jíl, nepropustná hornina); hnědý trojúhelník: vertikální pokles obsahu organického uhlíku (C-org). B: Schéma potravní sítě. Zelené šipky: přenos látek mezi trofickými úrovněmi. Zobrazen je pouze výběr možných vztahů. Téměř veškerá fauna podzemní vody se může příležitostně také živit organickým uhlíkem (C-org, zde detritem). Pozice jedince v potravní síti se může měnit během životního cyklu. Pouze větší jedinci mohou být konzumenty vyššího řádu, v závislosti na velikosti přijímacího otvoru. Podrobnosti jsou doposud většinou neznámé. C-anorg = anorganický uhlík; DOC = rozpuštěný organický uhlík. (Foto: L. Zappia, S. Schmidt, G. Colm, K. Euringer, P. Hirsch, U. Eisendle)
Cíl studie českých ekosystémů podzemních vod
Cílem naší studie je odpovědět na otázku, jakou strukturu potravních sítí můžeme očekávat za různých podmínek prostředí a které ekosystémové služby budou probíhat za různých okolností. Řešení těchto otázek vyžaduje komplexní pojetí zahrnující také studium mikrobiálních společenstev, trofických úrovní, požíracích schopností živočichů, parametrů prostředí a mnohých dalších ukazatelů. V prvním kroku je nezbytné zmapovat výskyt živočichů a zjistit parametry daného prostředí s výskytem konkrétních taxonů. Proto zde uvádíme doposud zjištěný přehled živočichů podzemních vod v Čechách. Zvolili jsme dvě oblasti sledování: 1) jižní Čechy a 2) oblast u Sokolova, kde bylo vytvořeno umělé experimentální povodí. Podzemní fauna se pravděpodobně do umělého povodí dostane podpovrchovými toky, a proto je užitečné mít přehled o zástupcích živočichů v jeho okolí. Kromě těchto cílů je důležitý i aspekt ochrany. V Červeném seznamu České republiky jsou jako zranitelné či ohrožené druhy uvedeny pouze čtyři druhy různonohých korýšů podzemních vod [31], pátý druh nelze z důvodu nedostatku informací vyhodnotit. Je možné, že podrobnější výzkumy přinesou nové nálezy, a vyhodnocení, že se druh vyskytuje často a není tak třeba zvláštní ochrany. Ovšem stejně tak je možný opačný scénář a výsledky ukáží nutnost vyšších ochranných opatření.
Hypotézy
Rozpuštěný kyslík, uhlík a živiny jsou obvykle limitujícími faktory pro mikroorganismy, a tak nepřímo omezují rovněž živočichy, kteří se jimi živí [32]. V jižním Německu Griebler a jeho spolupracovníci zjistili statisticky průkazné pozitivní vztahy mezi početností fauny a koncentracemi rozpuštěného organického uhlíku (DOC) ve zvodnělých vrstvách. V povodí Marblingerského potoka byly koncentrace dusičnanů významně vyšší ve zvodnělých vrstvách, kde byla detekována přítomnost živočichů [33]. Tyto závislosti jsou však nepřímými vztahy, neboť stygofauna (živočichové závislí na podzemní vodě) se neživí přímo DOC nebo dusičnany, ale živí se mikroorganismy spotřebovávajícími DOC a dusičnany [19]. V tomto předběžném výzkumu tak považujeme zvýšené koncentrace DOC a živin za ukazatel potenciálně vyšší mikrobiální biomasy. V následném výzkumu však bude přínosné stanovovat přímo mikrobiální biomasu. Koncentrace DOC a živin obvykle klesají v důsledku omezení přímé výměny s povrchem, tedy se vzdáleností či časem výměny [34]. Hlavním důvodem poklesu biomasy živočichů směrem od povrchu je pokles potravních zdrojů [35]. Proto jsme si stanovili následující hypotézy: 1) vzorky společenstev podzemních bezobratlých živočichů se kvantitativně i kvalitativně liší v závislosti na použité metodě odlovu, tedy sítě nebo pumpy, 2) zásadní rozdíl mezi živočichy v mělkých (převážně kvartérních) a hlubokých vrtech, 3) nárůst četnosti jejich početnosti s koncentrací DOC, 4) nárůst celkové i relativní početnosti s koncentrací rozpuštěného kyslíku, 5) nárůst celkové i relativní početnosti s rostoucími koncentracemi dusičnanů, amonných iontů a fosforečnanů, ale malý nebo žádný vliv kolísání pH. Protože tyto chemické vlastnosti závisejí alespoň částečně na hydrogeologickém prostředí, předpokládali jsme také, že 6) živočichové se nevyskytují ve všech hydrogeologických rajonech.
Metodika
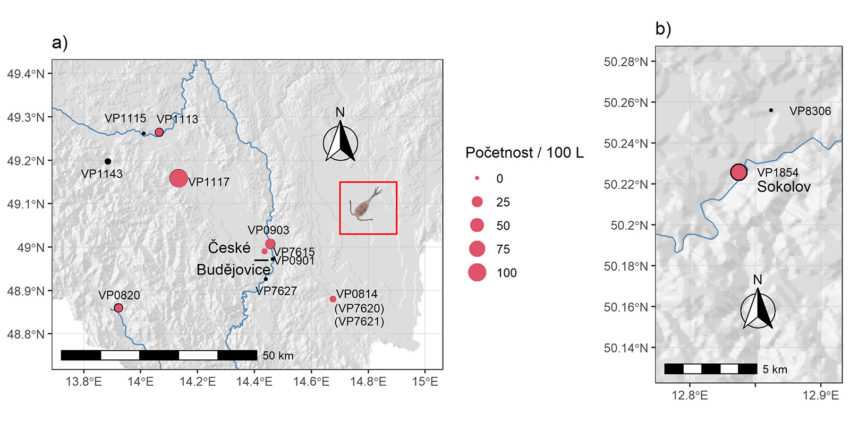
Vzorky podzemních vod byly odebrány v jižních Čechách (obrázek 2a) a v okolí Sokolova (obrázek 2b) ve vrtech sledovaných v rámci státní pozorovací sítě jakosti podzemních vod ČHMÚ. V rámci této sítě jsou vzorky vody z vrtů pro chemické analýzy odebírány v dynamickém stavu čerpáním pumou a analýzy jsou prováděny v laboratořích akreditovaných dle ČSN EN ISO/IEC 17025 v platném znění [36]. Přehledové mapy na obrázku 2 zobrazují první výsledky, viz níže. Během sledování ČHMÚ na podzim 2019 a na jaře 2020 byly odebrány vzorky živočichů ponořením úzké planktonní sítě (obrázek 3, [37]) na dno či do určité hloubky, následně byla síť 10x vyzvednuta na délku paže k promísení vody, a tažením k povrchu docházelo k filtraci vody. Ačkoli tato metoda není zcela kvantitativní, poskytuje dostatečný přehled o společenstvu živočichů žijících v konkrétním objektu [38]. Vrty jsou „okna“ do vodonosných vrstev. Zjištění živočichové jsou původem buď z navazující podzemní vody, nebo jsou suchozemského původu a do vrtu náhodně spadli a rychle hynou [39]. S výjimkou roztočů a chvostoskoků jsou rozdíly mezi živočichy původu suchozemského a z podzemní vody zřejmé. Příspěvek živočichů z povrchu samozřejmě ovlivňuje živočichy v podzemí jako potravní zdroj. Tyto okolnosti způsobují, že vrty nikdy kvantitativně nemohou být pro okolní podzemní vody zcela reprezentativní. Stále však platí, že živočichové podzemních vod se mohli do vrtu dostat pouze z podzemní vody v okolním prostředí a lze očekávat, že relativní četnost může být mezi vrty a okolními podzemními vodami alespoň podobná. Vzorky z vrtů je proto možné považovat za dostatečně informativní a způsobilé ke statistickým analýzám.

Obr. 2. Mapa lokalizace vzorkovaných vrtů. Černé kruhy představují celkovou početnost živočichů, červeně je početnost klanonožců. a) jižní Čechy (s obrázkem klanonožce v rámečku), b) dva vrty v okolí Sokolova
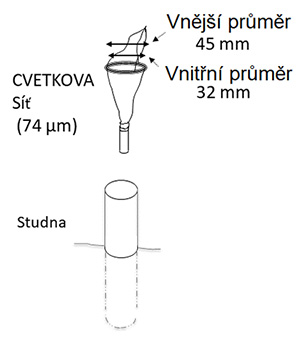
Obr. 3. Schéma postupu odběru vzorků. Úzká planktonní síť podle návrhu Cvetkova [37] o velikosti ok 74 µm nebo 50 µm je spuštěna do vrtu a následně vytažena
U některých vrtů (které nepatří mezi objekty monitorované ČHMÚ) nebyly k dispozici údaje o přesné hloubce. Pro porovnání počtů živočichů mezi vrty přepočítaných na jednotky objemu byla v takových případech předpokládána hloubka 20 m. Vlastní vstupní otvor planktonní sítě měří 3,2 cm, což odpovídá válci o poloměru 1,6 cm. Objem přefiltrované vody tak činí (0,016 m)2 × 3,1416 (π) × 20 m = 0,016 m3, zhruba 16 litrů. Pokud byla hloubka vrtu větší, vzorkovaný objem byl vypočítán s přesnou hloubkou. Tento výpočet je pouze přibližný, jelikož sediment studny je nejprve rozvířen, aby byli zachyceni alespoň nějací živočichové vázaní na dno vrtu. Vzorek lze tedy považovat za semikvantitativní, avšak i tyto informace jsou užitečné pro přiblížení standardizované početnosti.
Kromě odběru vzorků planktonní sítí přímo z vrtu byly odebrány i vzorky při čerpání vody čerpadly. Objem 10 až 50 litrů vody byl filtrován přes stejnou planktonní síť jako ve výše popsaném vzorkování. Musíme doplnit, že tyto vzorky jsou zatíženy selektivitou určitých skupin živočichů. Například hlísti se často vyskytují v jemných sedimentech a čerpadlem zavěšeným nade dnem nejsou postiženi. Obdobně mohou být podhodnocováni velmi mobilní různonožci, a opačně klanonožci ve volné vodě mohou být nadhodnocováni [40]. Proto by měly být v ideálním případě provedeny odběry vzorků pomocí planktonní sítě a čerpáním současně. Kromě vrtů ČHMÚ byla čerpána voda také z některých vesnických studní, pro které však nebyly k dispozici další informace; tato data jsou brána v úvahu pouze pro tabulku 1.
Tab. 1. Standardizovaná početnost živočichů (jedinci/100 l) rozdělených na vyšší taxonomické úrovně zjištěných v jednotlivých vrtech. Šedě jsou podbarveny vrty bez detekce živočichů. HR označuje Hydrogeologické rajony. T = Třeboňská pánev – jižní část; K = Krystalinikum v povodí Horní Vltavy a Úhlavy; B = Budějovická pánev, O = Kvartér Otavy a Blanice; S = Sokolovská pánev. Vrt: m = mělký; h = hluboký

Z chemických veličin měřených v podzemní vodě byly pro vyhodnocení použity pH, rozpuštěný organický uhlík (DOC) a živiny, fosforečnany PO4-P, NH4-N a NO3-N. Naměřené hodnoty z let 2019 a 2020 byly zprůměrovány pro každý monitorovací objekt. Někteří živočichové mohou žít až 10 let, proto i starší hodnoty mohou být relevantní. Pro zjednodušení analýz jsme vybrali jen aktuální hodnoty.
K řešení první hypotézy, zda se standardizovaná početnost bezobratlých živočichů liší mezi vzorky odebrané sítí či pumpováním, byl použit neparametrický Brunne–Munzelův t-test pomocí funkce npar.t.test [41]. Dále byl použit neparametrický ekvivalent testu MANOVA pomocí funkce adonis [42] pro určení rozdílu mezi společenstvy (vyjádřené relativní četností jednotlivých taxonů a upravené dvojitou odmocninovou transformací hodnot) vzorků získanými výše zmíněnými metodami odběru. Vizualizace společenstev byla provedena analýzou mnohorozměrného škálování (Multidimensional Scaling, MDS) s Bray–Curtisovou maticí vzdáleností, přičemž nulové početnosti byly nahrazeny hodnotou 0,00001, aby se algoritmus spustil. Byly testovány závislosti početnosti živočichů na chemických parametrech prostředí, hloubce vrtu a hydrogeologickém rajonu t-testem a lineární regresí. Rozdíly v početnostech vztažených na objem vody mezi mělkými a hlubokými vrty byly provedeny neparametrickým Brunne–Munzel t-testem a rozdíly mezi společenstvy mezi mělkými a hlubokými vrty neparametrický ekvivalentem MANOVA. Analýzy byly provedeny v programu R [43].
Výsledky
Početnosti zjištěných organismů zařazených do vyšší taxonomické úrovně jsou uvedeny v tabulce 1. Rozdíly mezi standardizovanými početnostmi bezobratlých živočichů odebraých sítí či pumpováním se statisticky nelišily (t = 0,30, 0,77; obrázek 4a). Vizualizace relativního množství jednotlivých taxonů neukázala větší podobnost společenstev odebraných sítí či pumpováním (obrázek 4b). Obdobně test mezi relativním výskytem živočichů z obou metod nebyl statisticky významný (adonis R2 = 0,02; p = 0,80) a první hypotéza tak byla zamítnuta.

Obr. 4. a) Krabicový diagram standardizované početnosti živočichů ve vzorcích získaných síťovými odběry a pumpováním, b) Diagram mnohorozměrného škálování (MDS) relativní početnosti ve vzorcích. Kolečka zobrazují síťové vzorky a trojúhelníky pumpované vzorky. Vážení taxonů ve vícerozměrném prostoru je zobrazeno šedě. Označení taxonů a symboly byly přesunuty tak, aby se nepřekrývaly. Elipsou jsou označeny vzorky, které náleží témuž centroidu, neboť v nich nebyli zjištěni žádní živočichové.
V souladu s druhou hypotézou byly pozorovány nižší četnosti (často absence) živočichů v hlubokých vrtech a naopak nejvyšší početnosti byly zaznamenány v mělkých vrtech (t = 4, 437, p = 0,0; tabulka 1, obrázek 5a). Statisticky průkazný byl i rozdíl v relativní početnosti jednotlivých taxonů mezi hlubokými a mělkými vrty (adonis R2 = 0,22, p = 0,041). Početnosti živočichů se zvyšovaly se zvyšující se koncentrací DOC (obrázek 5b), což potvrzuje třetí hypotézu. S rozpuštěným kyslíkem došlo k mírnému (statisticky neprůkaznému) poklesu početnosti (obrázek 5c), což je v rozporu se čtvrtou hypotézou.
Početnosti živočichů mírně (statisticky neprůkazně) klesaly s nárůstem koncentrace dusičnanů a amonných iontů (obrázek 5d, e), což je v rozporu s hypotézou 5 pro tyto dvě živiny. Závislosti jsou ale silně ovlivněny odchýlenými hodnotami a při větším počtu vzorků by se mohly změnit. Početnost narůstala s nárůstem koncentrace fosforečnanů, ačkoliv je vztah statisticky neprůkazný, trend podporuje hypotézu číslo 5. V souladu s hypotézou 5 není pH významným faktorem ovlivňujícím početnosti živočichů podzemních vod (obrázek 5g).
Proti očekávání v rámci hypotézy 6 byli živočichové nalezeni ve všech sledovaných hydrogeologických rajonech (obrázek 5h). Hlavním rozdílem mezi početností v jednotlivých rajonech byly zjevně odlišné podmínky. Například dva ze tří vrtů v Třeboňské pánvi byly extrémně hluboké artéské studny (hloubka 190 a 320 m), kde početnosti mikrobiálních společenstev dosahovaly hodnot laboratorní ultra-čisté vody (T. Shabarová, osobní sdělení). V takových podmínkách nemají živočichové dostatečné množství potravních zdrojů.

Obr. 5. Závislosti standardizované početnosti živočichů na hloubce vrtů, chemických parametrech prostředí a hydrogeologických rajonech. a) krabicový diagram početnosti živočichů v hlubokých a mělkých vrtech; b) závislost početnosti na DOC (rozpuštěný organický uhlík); c) závislost početnosti na koncentraci rozpuštěného kyslíku, d) závislost početnosti na koncentraci dusičnanů, e) závislost početnosti na koncentraci amonných iontů, f) závislost početnosti na koncentraci fosforečnanů, g) závislost početnosti na pH, h) hydrogeologické rajony. Zkratky hydrogeologických rajonů jsou uvedeny v tabulce 1. V grafech je zobrazena regresní křivka (modře), 75% intervaly spolehlivosti (šedě); mělké vrty jsou zobrazeny červenými tečkami a hluboké zelenými. Kolečka zobrazují síťové vzorky a trojúhelníky pumpované vzorky
Diskuse
Tento příspěvek uvádí předběžné výsledky pilotního vzorkování společenstev živočichů podzemních vod. Odebírání vzorků nejen pomocí sítě z vrtu, jak se děje při běžných monitorovacích studiích [např. 6], ale také odběr velkých objemů čerpáním vody během půlročního sledování vrtů ČHMÚ, nabízí unikátní možnost porovnání, zda se fauna ve vrtech systematicky liší. Autoři předešlých prací nejčastěji uvádějí, že rozdíly mezi společenstvy živočichů vlastního vrtu a okolní zvodnělé vrstvy jsou velmi malé, přičemž tyto dřívější studie pracovaly se vzorky získanými pumpami na menší objemy (pneumatické pístové čerpadlo: [44], [45]; odstředivé čerpadlo: [46]; čerpadlo oběžného kola: [47]; čerpání s pěchovacím systémem: [48]). Shodně s dřívějšími studiemi ani v této nebyly zjištěny rozdíly mezi společenstvy živočichů získaných sítí a (částečně) intenzivním pumpováním. Rozdíly ve vrtech a okolní zvodnělé vrstvě vody byly prokázány pro bakterie [48], které jsou však výrazně méně mobilní a nelze u nich očekávat přesuny mezi oblastmi s optimálními podmínkami. Živočichové vyskytující se ve vrtu jsou s největší pravděpodobností původem z okolní zvodnělé vrstvy, a proto lze očekávat při použití odběrové sítě či intenzivním pumpování (zahrnující i okolní prostředí) změny pouze v relativním zastoupení taxonů.
Schéma vzorkování jednotlivých hydrogeologických rajonů doposud nebylo zcela vyvážené k pokrytí mělkých a hlubokých vrtů. Výsledky jsou tak především orientační. I tak výsledky podporují některé naše hypotézy, jako například o nízké početnosti živočichů v hlubokých vrtech a lokálně velmi vysoké početnosti ve vrtech mělkých. Hlavním důvodem nízké početnosti živočichů v hlubokých vrtech je nedostatek potravy. Malá úživnost byla zjištěna v souvislosti s nejnižšími koncentracemi DOC a fosforečnanů, zatímco koncentrace sloučenin dusíku v mělkých vrtech vykazovaly různé hodnoty. Živiny a potravní zdroje pro živočichy mohly být v hlubokých objektech vyčerpány již dříve. Amonné ionty jsou produktem převážně rozkladu organických látek, který je stabilní v podmínkách vyčerpání rozpuštěného kyslíku a nízkého redoxního potenciálu. Avšak ani při zvýšených koncentracích amonných iontů a dusičnanů nebyly zaznamenány větší početnosti živočichů; tedy, i pokud by amonné ionty nebo dusičnany mohly sloužit jako živina pro mikroorganismy, které by byly potravou pro živočichy, jiný faktor zabránil rozvoji společenstva živočichů a možná i mikroorganismů.
Bez ohledu na hloubky vrtů amonné ionty ani dusičnany nebyly pozitivně korelovány s početností živočichů. V dalším výzkumu je třeba se zaměřit na zjištění závislosti biomasy mikroorganismů na koncentraci dusíku ve specifických podmínkách podzemních vod. Zajímavý je výsledek pozitivní závislosti početnosti živočichů na koncentraci fosforečnanů. Skutečnost, že početnost živočichů se zvyšuje s koncentrací fosforu, ale nikoli s koncentracemi dusíku, by mohla naznačovat, že dusík nebyl limitujícím faktorem, na rozdíl od fosforu. Tyto hypotézy je třeba v nadcházejícím výzkumu se společenstvy mikroorganismů řádně otestovat.
Ačkoli naměřené pH dosahovalo hodnot od kyselých po mírně zásadité, nebyl zjištěn vliv na početnost živočichů. Podzemní vody mají častěji kyselé pH a živočichové podzemních vod jsou tomu prostředí dobře přizpůsobeni.
Hydrogeologické rajony doposud nebyly dostatečně vzorkovány, aby bylo možné porovnat kvantitativní výskyty. I při zohlednění těchto nedostatků je výsledek zjištění živočichů ve všech typech monitorovacích objektů velmi nadějný. Nadcházející přesná determinace jednotlivých druhů ukáže, zda se jejich složení mezi rajony odlišuje a zda podzemní živočichy bude možné využít k definici stygoregionů, jež by sloužily jako ekvivalenty ekoregionů podpovrchových vod [6].
Na rozdíl od bakterií, u nichž je mnoho linií přizpůsobeno anoxickým podmínkám (anaerobióza), téměř všichni živočichové jsou závislí do určité míry na přítomnosti kyslíku. Zjištěná negativní závislost mezi početností živočichů a rozpuštěným kyslíkem tak nemusí být na první pohled zcela zjevná. Žádný z vrtů však nebyl zvláště mělký anebo v blízkosti povrchových vod, a tak nelze očekávat, že by dostávaly pravidelné dotace kyslíku. V takovýchto podmínkách jsou společenstva živočichů dobře přizpůsobena nízkým koncentracím kyslíku [49].
Zvodnělé vrstvy jsou stále častěji považovány za značně proměnlivé prostředí, zejména v mikroměřítku [19]. Je pravděpodobné, že i na první pohled anoxické prostředí poskytuje prostory s obsahem kyslíku. Většina živočichů je do jisté míry pohyblivá a mohou krátkodobě migrovat mezi mikrostanovišti, obdobně jako to bylo prokázáno v povrchových vodách u korýšů, kteří vstupují do anoxického prostředí při hledání potravy [50]. Fišer a kolektiv [35] došli k závěru, že koncentrace kyslíku zpravidla neomezuje výskyt živočichů v podzemních vodách. Tento trend je opačný než ve společenstvech povrchových vod, která jsou zvyklá na pravidelný přísun kyslíku, např. v hyporheické zóně [51]. Naše zjištění o negativním vztahu je pravděpodobně artefaktem z důvodu relativně malého počtu vzorků.
Jediný odběr vzorků může poskytnout pouze částečný obrázek o výskytu živočichů v podzemních vodách. Podle zjištění Gutjahra a kolektivu [52] a Hancocka a Boultona [53] jsou opakovanými odběry (až do čtvrtého vzorkování) detekovány stále nové druhy. Každý další odběr vzorků tak může zvýšit počet zjištěných druhů a může dojít ke změně pohledu na četnosti výskytu druhů a tím i zařazení do stupně ochrany, např. v Červeném seznamu ohrožených druhů [31].
V této fázi byla identifikace provedena pouze na úrovni tříd. Přesné určení druhů je časově velmi náročné a je plánováno na následující období. Pro identifikaci živočichů podzemních vod jsou aktuálně hledány specifické sekvence DNA, které budou využívány v molekulárních metodách jako alternativa k morfologické identifikaci [54] a budoucí projekty budou tuto metodu jistě zahrnovat.
Výhled
Na základě těchto prvních výsledků budeme nadále pokračovat v mapování biogeografického rozšíření živočichů podzemních vod. Některé taxony jsou vynikajícími ukazateli kvality vody [55]. Protože žijí měsíce a roky, lze jejich relativní hojnost považovat za integrující dlouhodobější podmínky prostředí, kde měření chemických vlastností představují pouze čas odběru vzorků. Znalosti o společenstvech organismů tak mohou dále informovat o střední až dlouhodobé situaci.
Větší soubor údajů nám pomůže objasnit strukturu společenstev živočichů podzemních vod na našem území. Na základě těchto informací vybereme reprezentativní druhy pro laboratorní experimenty, ve kterých budeme stanovovat míru požírací aktivity a dýchání. Tyto údaje jsou nezbytné pro výpočet toků látek ve zvodnělé vrstvě. To umožní objasnit ekosystémove služby poskytované společenstvem podzemních vod, přesněji, kolik uhlíku a živin, a jakého typu, společenstvo transformuje. Jinými slovy, na které druhy se nejvíce spoléháme při výrobě pitné vody. Tyto experimenty budou prováděny za různých podmínek, například při změnách teploty. Živočichové podzemních vod jsou na kolísání teploty velmi citliví [13, 14], proto existuje nebezpečí ztráty ekosystémových služeb s případným oteplením vody. Poté, co budou důsledky vlivu zvyšování teploty na ekosystém podzemní vody kvantifikovány, bude možné s předstihem plánovat řízení takové situace.
Poděkování: Výzkum podzemních živočichů je podpořen projektem MEMOBiC (EU Operační program Výzkum, vývoj a vzdělávání,
č. CZ.02.2.69/0.0/0.0/16_027/0008357) a projektem Biomanipulace jako nástroj zlepšení kvality vody nádrží, reg. č. CZ.02.1.01/0.0/0.0/16_025/0007417 financovaného z EFRR/ESF. Autoři dále děkují Dr. Petru Porcalovi a Dr. Josefu Hejzlarovi z Hydrobiologického ústavu BC AV ČR, v.v.i., Dr. Tanje Shabarové za provedení analýzy průtokové cytometrie vzorků a Dr. Vojtěchu Lantovi z Botanického ústavu AV ČR, v.v.i., za podíl na předběžných výsledcích. V neposlední řadě děkujeme Jaroslavu Bartoňovi z grafického studia Design69.cz za úpravu vizualizace, a vzorkařům provádějícím vzorkování podzemních vod v síti ČHMÚ. Podpořeno programem Strategie AV21 Záchrana a obnova krajiny.
Literatura/References
[1] Chen, Y.; Yang, J. X.; Zhu, Z. G. 1994. A new fish of the genus Sinocyclocheilus from Yunnan with comments on its characteristic adaptation (Cypriniformes: Cyprinidae). Acta Zootax Sin 19, 246–253. [2] Behrmann-Godel, J.; Nolte, A. W., Kreiselmaier, J.; Berka, R., Freyhof, J. 2007. The first European cave fish. Current Biology 27, R243-R258. [3] Briegleb, W. 1962. Zur Biologie des Grottenolms (Proteus anguinus Laur. 1768). Z. Morph. Ökol. Tiere 51, 271–334. [4] Vejdovsky, F. 1882. Tierische Organismen der Brunnengewaesser von Prag. Own publishing, Prague. 90 str. [5] Griebler, C.; Mösslacher, F. 2003. Grundwasser-Ökologie. Facultas Verlags- und Buchhandels AG., Wien. 495 str. [6] Stein, H.; Griebler, C.; Berkhoff, S.; Matzke, D.; Fuchs, A.; Hahn, H. J. 2012. Stygoregions – a promising approach to a bioregional classification of groundwater systems. Scientific Reports 2, 1–9. [7] Gibert, J.; Danielopol, D. L.; Stanford, J. A. 1994. Groundwater Ecology. Academic Press, San Diego, CA. 541 str. [8] Jones, J.; Mulholland, P. J. 2000. Streams and ground waters. Academic Press. 425 str. [9] Wilkens, H.; Culver, D.; Humphreys, W. F. Subterranean Ecosystems. Elsevier, Amsterdam. 808 str. [10] Straškraba, M. 1958. Beitrag zur Kenntnis der Verbreitung der Amphipoden in der Tschechoslowakei aus dem zoogeographischen Gesichtspunkt. Acta Univ Carol. Biol. 2, 197–208. [11] Ronneberger, D. 1975. Zur Kenntnis der Grundwasserfauna des Saale-Einzugsgebietes (Thueringen). Limnologica. 9, 323–419. [12] Hahn, H. J.; Matzke, D.; Fuchs, A.; Burghardt, D. 2013. Přeshraniční ekologické hodnocení podzemní vody pomocí zjištění fauny podzemních vod a stanovení stabilních izotopů v rámci projektu GRACE Cíle 3“ Shrnutí nejdůležitějších výsledků. 13 str. [13] Brielmann, H.; Griebler, C.; Schmidt, S. I.; Michel, R.; Lueders, T. 2009. Effects of thermal energy discharge on shallow groundwater ecosystems. FEMS Microbiol. Ecol. 68, 273–286. [14] Avramov, M.; Rock, T. M.; Pfister, G.; Schramm, K.-W.; Schmidt, S. I.; Griebler, C. 2013. Catecholamine levels in groundwater and stream amphipods and their response to temperature stress. Gen. Comp. Endocrinol. 194, 110–117. [15] Jeschke, J. M.; Heger, T. 2018. Invasion Biology. CABI. 188 str. [16] Fišer, C.; Sket, B.; Trontelj, P. 2008. A phylogenetic perspective on 160 years of troubled taxonomy of Niphargus (Crustacea: Amphipoda). Zool. Scr. 37, 665–680. [17] Griebler, C.; Avramov, M. 2015. Groundwater ecosystem services: a review. Freshw. Sci. 34, 355–367. [18] Rivett, M. O.; Buss, S. R.; Morgan, P.; Smith, J. W. N.; Bemment, C. D. 2008. Nitrate attenuation in groundwater: a review of biogeochemical controlling processes. Water Res. 42, 4215–32. [19] Schmidt, S. I.; Cuthbert, M. O.; Schwientek, M. 2017. Towards an integrated understanding of how micro scale processes shape groundwater ecosystem functions. Sci. Total Environ 592, 215–227. [20] Quevauviller, P. 2007. General introduction: the need to protect groundwater, in: Groundwater Science and Policy – An International Overview (Ed. Quevauviller P). RSC Publishing. 3–18. [21] The United Nations – World Water Development. 2009. The United Nations World Water Development Report 3: Water in a Changing World (No. 9789231040955). UNESCO, Paris. 100 str. [22] Ministerstvo zemědělství. 2019. Zpráva o stavu vodního hospodářství České republiky v roce 2018. 137 str. [23] Český statistický úřad. 2019. Statistická ročenka České republiky 2019. 828 str. [24] Herčík, L.; Jásek, J. 2013. Sto let Káranské vodárny. SOVAK Časopis Oboru Vodovodů Kanaliz. 7–8, 1–6. [25] Cavicchioli, R.; Ripple, W. J.; Timmis, K. N.; Azam, F.; Bakken, L. R.; Baylis, M.; Behrenfeld, M. J.; Boetius, A.; Boyd, P. W.; Classen, A. T.; Crowther, T. W.; Danovaro, R.; Foreman, C. M.; Huisman, J.; Hutchins, D. A.; Jansson, J. K.; Karl, D. M.; Koskella, B.; Mark Welch, D. B.; Martiny, J. B. H.; Moran, M. A.; Orphan, V. J.; Reay, D. S.; Remais, J. V.; Rich, V. I.; Singh, B. K.; Stein, L. Y.; Stewart, F. J.; Sullivan, M. B.; van Oppen, M. J. H.; Weaver, S. C.; Webb, E. A.; Webster, N. S. 2019. Scientists’ warning to humanity: microorganisms and climate change. Nat. Rev. Microbiol. 17, 569–586. [26] de Wit, H. A.; Valinia, S.; Weyhenmeyer, G. A.; Futter, M. N.; Kortelainen, P.; Austnes, K.; Hessen, D. O.; Räike, A.; Laudon, H.; Vuorenmaa, J. 2016. Current browning of surface waters will be further promoted by wetter climate. Environ. Sci. Technol. Lett. 3, 430–435. [27] Monteith, D. T.; Stoddard, J. L.; Evans, C. D.; Wit, H. A. D.; Forsius, M.; Jeffries, D. S.; Vuorenmaa, J.; Keller, B.; Wilander, A.; Skjelkva, B. L. 2007. Dissolved organic carbon trends resulting from changes in atmospheric deposition chemistry. Nature 450, 537–541. [28] Laudon, H.; Berggren, M.; Ågren, A.; Buffam, I.; Bishop, K.; Grabs, T.; Jansson, M.; Köhler, S. 2011. Patterns and dynamics of dissolved organic carbon (DOC) in boreal streams: the role of processes, connectivity, and scaling. Ecosystems 14, 880–893. [29] Šantrůčková, H.; Vrba, J.; Picek, T.; Kopáček, J. 2004. Soil biochemical activity and phosphorus transformations and losses from acidified forest soils. Soil Biol. Biochem. 36, 1569–1576. [30] Hrkal, Z. 2004. Changes in acid atmospheric deposition in Krušné Mts. and Šumava (Czech Republic) and their impact on groundwater quality. Water, Air, Soil Pollut. 157, 163–178. [31] Hejda, R.; Farkač, J.; Chobot, K. 2017. Červený seznam ohrožených druhů České republiky Bezobratlí – Red list. 103–104. [32] Griebler, C.; Stein, H.; Kellermann, C.; Berkhoff, S.; Brielmann, H.; Schmidt, S.; Selesi, D.; Steube, C.; Fuchs, A.; Hahn, H. J. 2010. Ecological assessment of groundwater ecosystems – Vision or illusion? Ecol. Eng. 36, 1174–1190. [33] Schmidt, S. I.; Hahn, H. J.; Hatton, T. J.; Humphreys, W. F. 2007. Do faunal assemblages reflect the exchange intensity in groundwater zones? Hydrobiologia 583, 1–19. [34] Schmidt, S. I.; Hahn, H. J. 2012. What is groundwater and what does this mean to fauna? – An opinion. Limnologica 42, 1–6. [35] Fišer, C.; Pipan, T.; Culver, D. C. 2014. The vertical extent of groundwater metazoans: An ecological and evolutionary perspective. BioScience 64, 1–9. [36] Kodeš, V.; Svátková, M.; Freisleben, J. 2016. Dvacet pět let systematického sledování jakosti podzemních vod v České republice. Vodohospodářské technicko-ekonomické informace 58/2, 4–10. [37] Cvetkov, L. 1968. Un filet phreatobiologique. Bull Inst Zool Mus Acad Bulg. Sci. 27, 215–218. [38] Schmidt, S. I.; Hahn, H. J.; Watson, G. D.; Woodbury, R. J.; Hatton, T. J. 2004. Sampling fauna in stream sediments as well as groundwater using one net sampler. Acta Hydrochim. Hydrobiol., 32, 131−137. [39] Sorensen, J. P. R.; Maurice, L.; Edwards, F. K.; Lapworth, D. J.; Read, D. S.; Allen, D.; Butcher, A. S.; Newbold, L. K.; Townsend, B. R.; Williams, P. J. 2013. Using boreholes as windows into groundwater ecosystems. PloS One 8, e70264. [40] Hahn, H. J.; Matzke, D. A. 2005. comparison of stygofauna communities inside and outside groundwater bores. Limnologica 35, 31–44. [41] Konietschke, F.; Placzek, M.; Schaarschmidt, S.; Hothorn, L. A. 2014. nparcomp: An R software package for nonparametric multiple comparisons and simultaneous confidence intervals. J. Stat. Softw. 61, 1–17. [42] Oksanen, J.; Blanchet, F. G.; Friendly, M.; Kindt, R.; Legendre, P.; McGlinn, D.; Minchin, P. R.; O’Hara, R. B.; Simpson, G. L.; Solymos, P.; Stevens, M. H. H.; Szoecs, E.; Wagner, H. 2019. vegan: Community Ecology Package. R package version 2.5–6. 1–10. [43] R Core Team, 2020. R: A Language and Environment for Statistical Computing. The R Foundation for Statistical Computing, Vienna, Austria. [44] Schmidt, S. I.; Hahn, H. J.; Watson, G. D.; Woodbury, R. J.; Hatton, T. J. 2004. Sampling fauna in stream sediments as well as groundwater using one net sampler. Acta Hydrochim. Hydrobiol. 32, 131−137. [45] Hahn, H. J.; Matzke, D. 2005. A comparison of stygofauna communities inside and outside groundwater bores. Limnologica 35, 31–44. [46] Dumas, P.; Fontanini, G. 2001. Sampling faunas in aquifers: a comparison of net-sampling and pump-sampling. Archiv für Hydrobiologie, 150(4), 661–676. [47] Allford, A.; Cooper, S. J. B.; Humphreys, W. F.; Austin, A. D. 2008. Diversity and distribution of groundwater fauna in a calcrete aquifer: does sampling method influence the story? Invertebr. Syst. 22, 127–138. [48] Sorensen, J. P. R.; Maurice, L.; Edwards, F. K.; Lapworth, D. J.; Read, D. S.; Allen, D.; Butcher, A. S.; Newbold, L. K.; Townsend, B. R.; Williams, P. J. 2013. Using boreholes as windows into groundwater ecosystems. PloS One 8, e70264. [49] Malard, F.; Hervant, F. 1999. Oxygen supply and the adaptations of animals in groundwater. Freshw. Biol. 41, 1–30. [50] Sell, A. F. 1998. Adaptation to oxygen deficiency : Contrasting patterns of haemoglobin synthesis in two coexisting Daphnia species. Comp. Biochem. Physiol. Part A. 120, 119–125. [51] Boulton, A. J.; Scarsbrook, M. R.; Quinn, J. M.; Burrell, G. P. 1997. Land-use effects on the hyporheic ecology of five small streams near Hamilton, New Zealand. N. Z. J. Mar. Freshw. Res. 31, 609–622. [52] Gutjahr, S.; Bork, J.; Schmidt, S. I.; Hahn, H. J. 2013. Efficiency of sampling invertebrates in groundwater habitats. Limnologica 43, 43–48. [53] Hancock, P. J.; Boulton, A. J. 2009. Sampling groundwater fauna: efficiency of rapid assessment methods tested in bores in eastern Australia. Freshw. Biol. 54, 902–917. [54] Asmyhr, M. G.; Cooper, S. J. B. 2012. Difficulties barcoding in the dark: The case of crustacean stygofauna from eastern Australia. Invertebr. Syst. 26, 583–591. [55] ČSN. 2011. ČSN 75 7716 (757716) – Jakost vod – Biologický rozbor – Stanovení saprobního indexu.
1) Dr. Susanne Isabel Schmidt, Dipl.-Biol.
2) Mgr. Vít Kodeš, Ph.D.
2) Mgr. Miroslava Svátková
1) RNDr. Petr Blabolil, Ph.D.
1) Biologické centrum AV ČR, v.v.i.
Hydrobiologický ústav
Na Sádkách 702/7
370 05 České Budějovice
susanne.schmidt()hbu.cas.cz
petr.blabolil()hbu.cas.cz
2) Český hydrometeorologický ústav
Na Šabatce 2050/17
143 06 Praha 4–Komořany
vit.kodes()chmi.cz
miroslava.svatkova()chmi.cz