Autoři
Lenka Wimmerová, Eva Horáková, Martin Lexa
Klíčová slova
mikroplasty – definice – odběr – předúprava – analýza – slepý vzorek
Analýza mikroplastů je stále aktuální téma, nejen z pohledu zkoumání vlivu těchto částic na životní prostředí. Již víme, že ve vodním prostředí se jich nachází mnoho. Problematické je ale jejich vyčíslení a identifikace kvůli strukturálním změnám jejich povrchu. Velmi významným faktorem analýzy mikroplastů je také odběr vzorků v terénu, protože zde zpravidla dochází ke kontaminaci vzorku a často není zajištěn odběr slepých vzorků. Při předúpravě vzorků se také stále používají nevhodné postupy, které vedou ke znehodnocení malých mikročástic (<10 µm). Příspěvek je proto zaměřen na vyhodnocení výskytu mikroplastů ve vodách s využitím aktivních a pasivních metod vzorkování a různých analytických technik, od kvantitativních (mikroskopických) až po kvalitativní (zejména µRaman, µFTIR). Současně je zmíněna problematika stárnutí plastů a časová a finanční náročnost analýz mikroplastů ve vodách.
1. Úvod
Výskyt mikroplastů ve vodách je i v současnosti aktuální téma. Přestože je tato problematika zkoumána a diskutována řadu let, stále nejsou některé skutečnosti spojené s těmito částicemi a jejich chováním ve vodním, ale i terestrickém prostředí dostatečně objasněny nebo jsou dokonce neznámé. To se týká jak jejich vlivu na organismy, tak i standardizace analytických postupů jejich stanovení i vlastní definice mikroplastů. V současnosti je mezi odbornou komunitou obecně akceptována definice mikroplastů jako částic „syntetického původu, zejména plastového, a jejich úlomků o velikosti od 0,1 µm do 5 mm, resp. v případě vláken s délkou do 15 mm“. Již z této obecné definice je zřejmé, že mikroplastové částice svým rozměrem přesahují oblast mikro-, a zasahují jak do oblasti nano-, tak mili-, což je jeden ze signifikantních faktorů ovlivňujících složitost jejich analýzy. Analýza mikroplastů má však i další proměnné. Například druh materiálu mikroplastové částice. Zatímco v případě původu (tj. vzniku) mikroplastů se odborná komunita shodne na tom, že mezi mikroplasty patří jak částice primárního, tak sekundárního původu, v případě druhu plastového materiálu tomu tak není. Někteří autoři trvají na syntetickém a současně polymerním charakteru původního materiálu, jiní mezi ně řadí také celulózu či celofán. Přestože zařazování celulózy mezi mikroplastové materiály se může zdát jako nevýznamné, z pohledu analytického to důležité je, jelikož celulózních částic a vláken se v běžných vzorcích vod vyskytuje více než dost a zpravidla převyšují počet „klasických“ plastových částic z polyethylenu (PE), polypropylenu (PP), polystyrenu (PS), polyvinylchloridu (PVC), polyethylentereftalátu (PET) a polyesterových (PES) vláken, které patří ve vodách k nejčastěji zachyceným [1, 2, 3].
Složitost celé problematiky mikroplastů dokládá také několikaletá diskuse na toto téma na úrovni Evropské komise (EK) a Evropské chemické agentury (ECHA) a dalších odborných institucí, která vyústila v loňském roce k přijetí nařízení komise (EU) 2023/2055, kterým byla změněna příloha XVII nařízení Evropského parlamentu a Rady (ES) č. 1907/2006 REACH. Aktualizace stávající legislativy byla nezbytná, protože EK stanovila v roce 2022 zákaz užívání primárních mikroplastů ve vybraných produktech, zejména kosmetických [4, 5]. Nicméně současně je třeba uvést, že EK v tomto nařízení naopak rozšířila definici mikročástic o syntetické polymerní mikročástice o velikosti menší než 0,1 µm, protože se domnívá, že představují pro životní prostředí stejné, ne-li potenciálně vyšší riziko. Současná legislativně platná definice syntetických polymerních mikročástic tedy zahrnuje „polymery v částicích nebo v částicích povlaků menší než 5 mm ve všech rozměrech a vláknité částice kratší než 15 mm“, což je z analytické pohledu problém. Proto EK současně k nové definici mikroplastů doplnila, že je jí zřejmé, že analýza částic menších než 0,1 µm v jakémkoli rozměru či do délky 0,3 µm má v současné době omezené možnosti. Proto by daný limitní rozměr (tj. 0,1 µm, resp. 0,3 µm) neměl být uplatňován v rámci sankcí a jiných restrikčních opatření vůči výrobcům do té doby, než budou k dispozici nové nebo zdokonalené analytické postupy umožňující validní zjištění jejich přítomnosti a jejich kvantifikaci (odst. 45 [5]). Současně komise jasně definovala druh materiálu mikroplastových částic a z jejich definice vyloučila přírodní, rozložitelné a rozpustné polymery, a dále polymery bez atomů uhlíku ve své struktuře (odst. 44 [5]), čili celulóza ani celofán by neměly být mezi mikroplasty již dále zařazovány.
2. Odběr vzorků
Odběr vzorků a manipulace s nimi jsou velmi významnými kroky v rámci analýzy mikroplastů. Tyto dva kroky totiž představují největší riziko druhotné kontaminace vzorků, a to nejen z použitých materiálů vzorkovnic a technického vybavení, ale také z ovzduší či nevhodného oděvu a obuvi vzorkaře. Proto je doporučováno v rámci odběru používat slepý vzorek (např. vzorkovnici naplněnou ultračistou vodu, se kterou se manipuluje na lokalitě stejně jako s ostatními vzorky), nebo i tzv. nepřímý slepý vzorek, což je vzorek, do kterého se přidá definovaný hmotností podíl vybraného mikroplastového standardu, jehož úbytek je v rámci analytického postupu dále sledován [1, 6]. Obecně důležité je před vlastním odběrem vždy zvážit, jaké druhy mikroplastů by se mohly ve vodním zdroji vyskytovat. Některé plastové částice jsou totiž výrazně lehčí než voda, a budou se tedy vyskytovat u hladiny, zatímco jiné budou mít tendenci se koncentrovat u dna. Ideální je proto vzorkovat stratifikačně, tj. ve více úrovních, nicméně toto nemusí být vždy proveditelné.
V současné praxi je u povrchových i odpadních vod využíván především aktivní odběr vzorků. Pasivní odběry jsou realizovány minimálně. Základní metodou aktivního odběru je odběr předem definovaného objemu vody do skleněných nádob, zpravidla o objemu 1 litru, příp. 5 litrů, nebo vzorkování pomocí vlečné sítě typu Manta nebo Bongo [7, 8]. Pasivní odběr je v případě mikroplastů spíše výjimkou a používá se pouze u přirozeně tekoucích vod. Odběr je realizován opět zpravidla nerezovým sítem či sítí, které jsou umístěné ve vzorkovaném vodním toku po určitou dobu, např. 5–10 dnů nebo do té doby, než přefiltrují požadovaný objem vody [9]. Nevýhodou je nutnost jejich pravidelné kontroly, protože jsou časté jejich ztráty a poškození z důvodu lidské či zvířecí zvědavosti nebo přívalovými srážkami.
V případě mikroplastů je také vždy důrazně doporučováno, aby odběr prováděl proškolený vzorkař, a nikoliv dobrovolníci v rámci dnes populární tzv. Občanské vědy (Citizen Science). Hrozí totiž znehodnocení vzorků, a tedy i významné ovlivnění jejich vypovídající hodnoty. Vzorky mohou být také ovlivněny částicemi ze vzduchu, proto je vhodné zkracovat dobu odběru na minimum, a jak již bylo zmíněno výše, vždy odebírat slepé vzorky [1].
3. Předúprava vzorků
Úprava vzorku před vlastní analýzou mikroplastů se realizuje nejčastěji za účelem odstranění přebytečné organické hmoty. V praxi jsou nejvíce využívány metody oxidace, hustotní flotace, filtrace a sušení.
U oxidace jsou nejčastěji využívána oxidační činidla jako peroxid vodíku (H2O2), Fentonovo činidlo (Fe2+/H2O2) a chlornan sodný (NaClO). Pro hustotní separaci se zpravidla přidává roztok chloridu sodného (NaCl) či jodidu sodného (NaI), které zajistí, že se většina částic usadí u dna, zatímco mikroplasty zůstanou na hladině nebo rozptýlené v roztoku [10]. Velmi dobré výsledky jsou při hustotní separaci dosahovány také s chloridem zinečnatým (ZnCl2). Ten však nelze doporučit s ohledem na jeho vysokou toxicitu vůči vodnímu prostředí. Současně je doporučováno postup hustotní separace provést několikrát za sebou, i za použití jiného solného roztoku, protože jednorázová aplikace nemusí vyseparovat všechny mikroplastové částice [3]. Následná filtrace vzorků vod je zpravidla prováděna vakuově, ve skleněné aparatuře přes skleněné filtry, případně přes filtry z nitrát celulózy nebo teflonu [2, 4]. Při použití teflonových (PTFE) filtrů je nicméně nutné věnovat zvýšenou pozornost tomuto materiálu při následné identifikaci, protože teflon mezi mikroplasty patří.
Zajímavé může být také použití filtrů z nerezu [9, 11], které však nejsou komerčně dostupné, a již výše zmíněného nepřímého slepého vzorku [6]. Jako mikroplastové standardy pro tyto vzorky jsou nejčastěji využívány sférické PP nebo PE částice bezbarvé či zabarvené (např. od firmy Cospheric LLC, USA), které mohou být obarveny i fluorescenčním barvivem přímo z výroby, což zjednodušuje jejich identifikaci. Další možností je využití elektrostatického odlučovače, kterým je možné oddělit částice mikroplastů v závislosti na vodivosti a schopnosti nést náboj. Felsing a kol. [12] tímto procesem dosáhl úspěšnosti separace mikroplastů přes 95 %. Metoda je ovšem nejen podmíněna kvalitní přípravou a vysušením vzorku, ale také nutností mít k dispozici tento přístroj, který nepatří mezi běžnou výbavu vodohospodářské laboratoře.
Každopádně ať už analytik zvolí jakýkoliv postup předúpravy vzorků, je vždy nezbytné pamatovat na to, že postupy mohou nejen poškodit povrch mikročástic, ale také je mohou zcela zlikvidovat. To se týká zejména částic s rozměrem pod 100 µm. Např. přestože většina autorů vědeckých publikací preferuje k rozkladu biologické hmoty peroxid vodíku či Fentonovo činidlo a následné sušení při 65–70 °C [1, 13], nelze tento postup doporučit, protože dle našich zkušeností zpravidla vede k významnému poškození povrchu mikroplastových částic, což prakticky znemožňuje jejich identifikaci.
4. Analytické metody
Pro analýzu mikroplastů je v současnosti využíváno několik různých postupů. Analytický monitoring bývá nejčastěji realizován pomocí mikro-FTIR (Fourierovy transformační červené mikroskopie) v kombinaci s ATR (zeslabenou úplnou reflektancí) či pomocí RS (Ramanovy spektroskopie). V dostupné literatuře jsou také zmiňovány techniky SEM-EDS (skenovací elektronová mikroskopie v kombinaci s energetickou disperzní spektroskopií) a XRF (rentgen-fluorescenční spektrometrie) [3]. V poslední době byl zaznamenán větší rozvoj využití techniky pyr-GC/MS (pyrolýzní plynové chromatografie s hmotnostní detekcí), která je sice finančně nákladná, ale umožňuje identifikaci nejmenších částic mikroplastů a částečně také nanoplastů [2, 14].
Všechny tyto techniky se mohou použít ke stanovení počtu a zejména ke stanovení kvality (resp. druhu) mikroplastů. Důležitým faktorem při výběru analytické metody je velikost analyzovaných mikroplastových částic. Zatímco technika µ-FTIR je vhodná ke stanovení mikroplastových částic od 10 µm do 400 µm, technika ATR-FTIR je doporučována pro větší částice nad 400 µm [15]. Naopak mikroplasty pod 10 µm je možné analyzovat pomocí Ramanu a pyr-GC/MS [14, 16].
V současné době je již rovněž poměrně dobře rozvinutá optická obrazová analýza s využitím barviv, jako jsou bengálská červeň (Bengal Rose) či fluorescenční Nile Red [2, 16]. Tyto techniky se však dají použít pouze pro stanovení počtu mikroplastů a v případě jejich použití je třeba pozornost věnovat návaznosti prací, protože není možné kombinovat některé analytické postupy, např. kvantitativní fluorescenční optickou analýzu s kvalitativní analýzou mikroplastů pomocí RS.
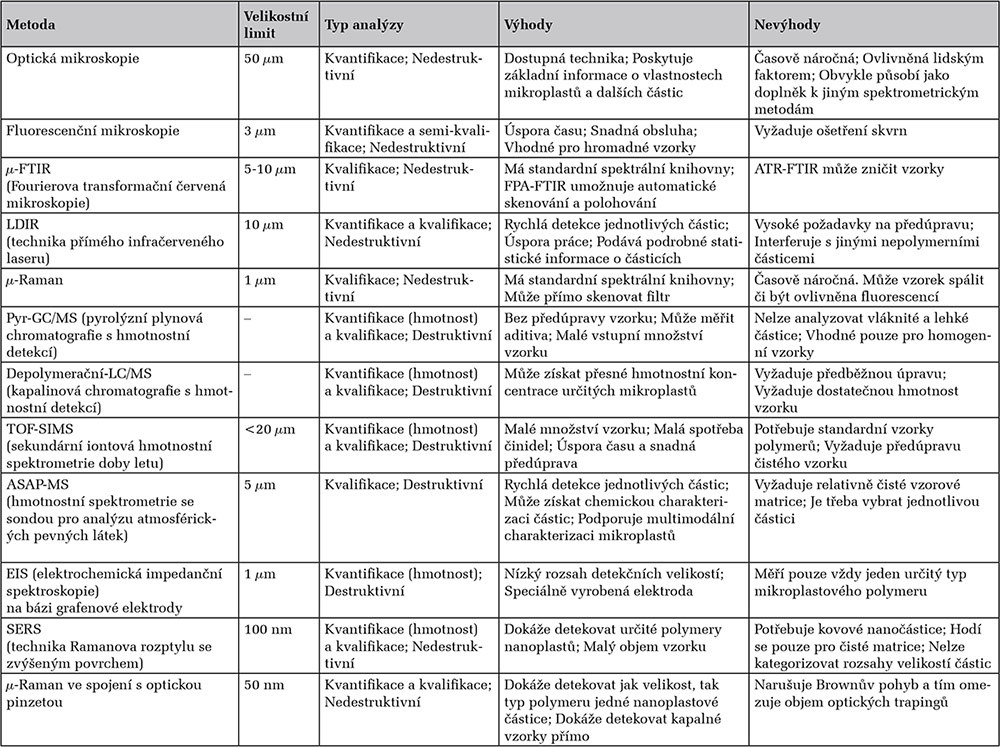
Aktuální přehled srovnávající vybrané dostupné metody analýzy mikroplastů shrnuje tabulka 1 [17].
Tab. 1. Srovnání vybraných technik detekce mikroplastů (upraveno dle Dong a kol. [17])
V souvislosti s analytikou mikroplastů je vhodné doplnit, že v roce 2019 bylo publikováno přehledné a již několikrát v tomto příspěvku zmíněné review autorského kolektivu Koelmans a kol. [1] sumarizující nejen dostupná data o výskytu mikroplastů ve sladkovodních a pitných vodách, ale také kriticky hodnotící do té doby použité metodiky vzorkování, předúpravy a analýzy mikroplastů ve vodách. Přestože v posledních letech bylo publikována řada odborných článků z oblasti analytiky mikroplastů, kdy za pozornost určitě stojí publikace kolektivu prof. Vollertsena z Aalborg University v Dánsku (viz např. Lykkemark a kol. [14]; Lui a kol.[15]; Maurizi a kol.[18]), či již v tabulce referovaný Dong a kol. [17], je review Koelmans a kol. [1] i v současnosti považováno za jednu ze základních publikací v této oblasti.
5. Průkaznost analýzy a její časová a finanční náročnost
Mikroplasty se podle původu dělí do dvou kategorií, na primární a sekundární. Mezi primární mikroplasty patří ty, které mají již před vstupem do prostředí velikost mikroplastů, tj. u částic <5 mm a u vláken <15 mm, a mají tedy tzv. „synteticko-polymerní“ charakter. Primární mikroplasty vznikají přímou výrobou a používají se jako součást řady produktů (např. kosmetiky, čisticích prostředků). Jak již bylo zmíněno výše, EK ve spolupráci s Evropskou chemickou agenturou zakázala používání primárních mikroplastů v některých výrobcích, protože se dle jejích odhadů tímto způsobem do životního prostředí každoročně dostávalo více než 42 tis. tun mikroplastů. Současně bylo odhadnuto, že omezení vypouštění primárních mikroplastů zabrání uvolnění cca 500 tis. tun těchto částic do životního prostředí v budoucnu [4].
Druhou skupinou jsou mikroplasty sekundární. To jsou částice vzniklé z větších plastových výrobků jejich opotřebením, rozpadem (degradací), působením chemických látek či působením UV-záření [4, 19, 20]. Zdrojem těchto sekundárních mikroplastových částic a vláken jsou často PET láhve, plastové sáčky, rybářské sítě, různé typy kuchyňských nádob, čajové sáčky apod. Sekundární mikroplasty mohou vznikat také při praní syntetických oděvů nebo mytí nádobí (v současnosti často diskutované plastové obaly pracích a mycích kapslí), oděrem pneumatik nebo rozkladem plastového odpadu. Omezení primárních mikroplastů je i v souvislosti se sekundárními mikroplasty velmi důležité, protože i tyto částice se dále rozpadají a z primárních mikroplastů mohou vznikat částice nanoplastů. Za zmínku určitě stojí fakt, že podle dostupných dat OSN z roku 2017 plave v mořích až 51 bilionů částic mikroplastů, což je přibližně 500krát víc, než kolik je v naší galaxii hvězd [21].
Původ mikroplastů je jen jedním z mnoha faktorů určujícím průkaznost analytického stanovení mikroplastů. Další významné faktory jsou již zmíněny výše a souvisí s vlastním odběrem, předúpravou a analýzou těchto částic. Signifikantní roli hraje také stáří, resp. proces stárnutí mikroplastových částic a vláken. Výzkumy bylo potvrzeno, že stárnutí významně mění fyzikálně-chemické vlastnosti mikroplastů [22], což znesnadňuje jejich identifikaci, a současně může vést k uvolňování aditiv a zvýšení jejich environmentálního rizika. Dále bylo potvrzeno, že změny ve struktuře povrchů působí progresivně ve smyslu povrchové aktivity mikroplastů, a jejich částice se pak snadněji stávají nosičem toxických látek (např. PAU) a těžkých kovů [23, 24, 25] či biomasy [26] nebo dokonce invazivních druhů řas [27]. To jsou další faktory omezující identifikaci mikroplastových částic, zejména tu kvalitativní. Důležité je neopomenout také roli obsahu organických látek pocházejících z říčních či mořských sedimentů nebo přítomnost kalů, které mají rovněž dopad na identifikaci mikroplastových částic [9, 28]. Vždy je nezbytné správně zvolit a provést předúpravu odebraných vzorků, jinak totiž nebude možné jednotlivé částice a vlákna mikroplastů nejen spočítat, ale především identifikovat.
V neposlední řadě v identifikaci mikroplastů hraje zásadní roli dostupnost databázových knihoven a standardů mikroplastů (např. SLoPP a SLoPP-E knihovny pro Raman nebo FLoPP a FLoPP-e knihovny pro ATR_FTIR, obě viz [29]. I přesto, že v posledním desetiletí došlo ke značnému rozvoji v této oblasti, řada analytiků si stále vypomáhá vlastními knihovnami, které umožňují identifikaci mikroplastů z konkrétních zdrojů, např. výrobků různého stáří i různých velikostí.
Ukázka srovnání spekter interní knihovny je k dispozici na obr. 1.
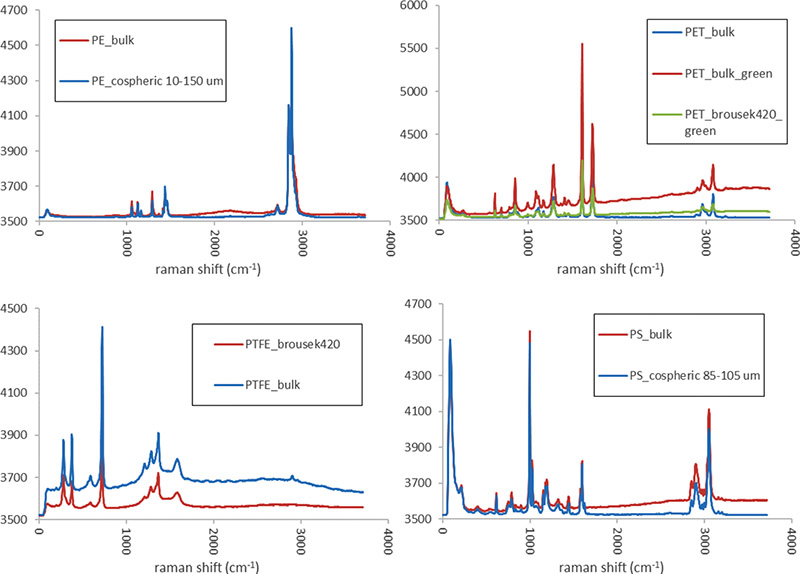
Obr. 1. Ukázka rozdílnosti spekter PE, PET, PTFE a PS mikroplastových částic pocházejících z vybraných zdrojů. Přístroj: Raman WiTec WMT50 s mikroskopem alpha300 R, excitační laser 532 nm, výkon 3-30 mV. Autor: Martin Lexa
Závěrem je třeba zmínit, že časová náročnost analýzy mikroplastů je významný faktor, který spolu s drahými analytickými přístroji a nezbytností použití zkušené pracovní síly významně ovlivňuje cenu jejich analýzy. A to jak kvantitativní, tak kvalitativní. První fáze zpracování jednoho vzorku vody zpravidla trvá 24–72 hod. v závislosti na doprovodných nečistotách, zejména obsahu biomasy, nerozpuštěných látek, či sedimentu, a také na zvoleném postupu předúpravy vzorku a případné potřebě barvení a sušení vzorků. V druhé fázi je třeba počítat s časovou dotací min. 12–24 hod. na nasnímání filtrů a dalších 12 hod. na identifikaci naměřených spekter. Cena za analýzu mikroplastů v jednom vzorku vody tak v současnosti neklesá pod 15 tis. Kč (bez DPH) a nedá se předpokládat, že by v dohledné době došlo k jejímu snížení.
6. Závěr
Analýza mikroplastů rozhodně není jednoduchou záležitostí. Přestože v posledních deseti letech došlo k významnému pokroku v této oblasti, stále není postup jejich stanovení nejen ve vodách, ale také v půdách, standardizován. Dále neexistuje unifikovaný přístroj, na kterém by bylo možné stanovovat všechny velikostní a druhové frakce těchto částic. V současnosti tak není možné srovnávat dosažené výsledky výskytu mikroplastových částic i vláken, pokud stanovení nebylo provedeno nejen shodnou analytickou metodou, ale nebyla také použita shodná metodika odběru a předúpravy vzorku. Další výzkum, zejména aplikovaný, je tak v oblasti analytiky mikroplastů jednoznačně nezbytný.
Poděkování: Tento příspěvek byl připraven na základě výsledků dosažených v rámci řešení projektu č. FV40126 „Pokročilé sorbenty pro separaci mikroplastů a mikropolutantů z vod“ realizovaného za finanční podpory z prostředků státního rozpočtu prostřednictvím Ministerstva průmyslu a obchodu ČR v programu TRIO.
Literatura/References
[1] Koelmans, A. A.; Nor, N. H. M.; Hermsen, E.; a kol., 2019: Microplastics in freshwaters and drinking water: Critical review and assessment of data quality. Water Res. 155:410–422. DOI: 10.1016/j.watres.2019.02.054 [2] Silva, A. B.; Bastos, A. S.; Justino, C. I. L.; a kol., 2018: Microplastics in the environment: Challenges in analytical chemistry – A review. Anal. Chim. Acta 1017:1–19. DOI: 10.1016/j.aca.2018.02.043 [3] Rocha-Santos, T.; Duarte, A. C., 2015: A critical overview of the analytical approaches to the occurrence, the fate and the behavior of microplastics in the environment. TrAC Trends in Analytical Chemistry 65:47–53. DOI: 10.1016/j.trac.2014.10.011 [4] Evropská chemická agentura (ECHA), ©2018-2023: Hot topics – Microplastics. Dostupné z: https://echa.europa.eu/cs/hot-topics/microplastics [5] Nařízení komise (EU) 2023/2055, ze dne 25. 9. 2023, kterým se mění příloha XVII nařízení Evropského parlamentu a Rady (ES) č. 1907/2006 o registraci, hodnocení, povolování a omezování chemických látek (REACH), pokud jde o syntetické polymerní mikročástice. Dostupné z: http://data.europa.eu/eli/reg/2023/2055/oj [6] Campo, P.; Holmes, A.; Coulon, F., 2019: A method for characterisation on microplastics in sludge. MethodsX 6:2776–2781. DOI: 10.1016/j.mex.2019.11.020 [7] Park, H.; Park, B., 2021: Review of microplastic distribution, toxicity, analysis methods, and removal technologies. Water 13(19):2736. DOI: 10.3390/w13192736 [8] Pasquier, G.; Doyen, P.; Kazour, M.; a kol., 2022: Manta net: The golden method for sampling surface water microplastics in aquatic environment. Front. Environ. Sci. 10:811112. DOI: 10.3389/fenvs.2022.811112 [9] Šenková, E., 2023: Mikroplasty v povrchových vodách. Bakalářská práce. ČZU v Praze, Fakulta životního prostředí, Praha, str. 77. Dostupné z: https://theses.cz/id/gf2u3k/ [10] Van Cauwenberghe, L.; Claessens, M.; Vandegehuchte, M. B.; a kol., 2015: Microplastics are taken up by mussels (Mytilus edulis) and lungworms (Arenicola marina) living in natural habitats. Environ. Pollut. 199:10–17. DOI: 10.1016/j.envpol.2015.01.008 [11] Šolcová, O.; Wimmerová, L., 2023: Jak vychytat mikroplasty: Vesmír 102(4):205. Dostupné z: https://vesmir.cz/cz/casopis/archiv-casopisu/2023/cislo-4/jak-vychytat-mikroplasty.html [12] Felsing, S.; Kochleus, C.; Buchinger, S.; a kol., 2018: A new approach in separating microplastics from Environmental samples based on their electrostatical behavior. Environ. Pollut. 234:20–28. DOI: 10.1016/j.envpol.2017.11.013 [13] Masura, J.; Baker, J.; Foster, G.; a kol., 2015: Laboratory methods for the analysis of microplastics in the marine environment: Recommendations for quantifying synthetic particles in water and sediments. Technical Memorandum NOS-OR&R-48. NOAA Marine Debris Division, Silver Spring, USA, 31 s. Dostupné z: https://repository.oceanbestpractices.org/bitstream/handle/11329/1076/noaa_microplastics_methods_manual.pdf [14] Lykkemark, J.; Mattonai, M.; Vianello, A.; a kol., 2023: Step-by-Step evaluation of matrix effect and sample recovery during pretreatment of wastewater samples for the quali-quantitation of microplastics by Py-GC-MS. In: Cocca, M.; Ambrogi, V.; Avolio, R.; a kol. (eds): Proceedings of the 3rd International Conference on Microplastic Pollution in the Mediterranean Sea. ICMPMS 2022. Springer Water, Springer, Cham., Švýcarsko. DOI: 10.1007/978-3-031-34455-8_3 [15] Liu, Y.; Lüttjohann, S.; Vianello, A.; a kol., 2024: Detecting small microplastics down to 1.3 µm using large area ATR-FTIR. Mar. Pollut. Bull. 198:115795. DOI: 10.1016/j.marpolbul.2023.115795 [16] Wimmerová, L.; Henzlová, L.; Lexa, M., 2020: Mikroplasty ve vodách – jejich analýza a toxicita pro vodní organismy. Vodní hospodářství vh9/2020:1–4. Dostupné z: https://vodnihospodarstvi.cz/mikroplasty-ve-vodach-jejich-analyza-a%E2%80%AFtoxicita-pro-vodni-organismy/ [17] Dong, H.; Wang, X.; Niu, X.; a kol., 2023: Overview of analytical methods for the determination of microplastics: Current status and trends. TRAC 167:117261. DOI: https://doi.org/10.1016/j.trac.2023.117261 [18] Maurizi, L.; Iordachescu, L.; Kirstein, I. V.; a kol., 2023: It matters how we measure – Quantification of microplastics in drinking water by µFTIR and µRaman. Helyion 9:e20119. DOI: 10.1016/j.heliyon.2023.e20119 [19] Auta, H. S.; Emenike, C. U.; Fauziah, S. H., 2017: Distribution and importance of Microplastics in the marine environment: A review of the sources, fate, effects and potential solutions. Environ. Int. 102:165–176. DOI: 10.1016/j.envint.2017.02.013 [20] Wagner, M.; Scherer, Ch.; Alvarez-Muñoz, D.; a kol., 2014: Microplastics in freswater ecosystems: What we know and what we need to know. Environ. Sci. Eur. 26:12. DOI: 10.1186/s12302-014-0012-7 [21] Evropský parlament (EP), 2022: Mikroplasty: Odkud se berou, co způsobují a jak se jich zbavit? Referenční číslo: 20181116STO19217. Dostupné z: https://www.europarl.europa.eu/topics/cs/article/20181116STO19217/mikroplasty-odkud-se-berou-co-zpusobuji-a-jak-se-jich-zbavit [22] He, W.; Liu, S.; Zhang, W.; a kol., 2023: Recent advances on microplastic aging: Identification, mechanism, influence factors, and additives release. Sci. Total Environ. 889:164035. DOI: 10.1016/j.scitotenv.2023.164035 [23] Mai, L.; Bao, L.-J.; Shi, L.; a kol., 2018: Polycyclic aromatic hydrocarbons affiliated with microplastics in surface waters of Bohai and Huanghai Seas, China. Environ. Pollut. 241:834–840. DOI: 10.1016/j.envpol.2018.06.012. [24] Heinrich, P.; Braunbeck, T., 2019: Microplastic testing in vitro: Realistic loading of pollutants, surfactant-free solid surphase-dosing and bioanalytical detection using a sensitivity-optimised EROD assay. In Vitro Toxicol. 54:194–201. DOI: 10.1016/j.tiv.2018.10.002 [25] Conesa, J. A.; 2022: Adsorption of PAHs and PCDD/Fs in Microplastics: A Review. Microplastics 1(3):346–358. DOI: 10.3390/microplastics1030026 [26] Beloe, C. J.; Browne, M. A.; Johnston, E. L., 2022: Plastic debris as a vector for bacterial disease: An interdisciplinary systematic Review. Environ. Sci. Technol. 56:2950−2958. DOI: 10.1021/acs.est.1c05405 [27] García-Goméz, J. C.; Garrigós, M.; Garrigós, J., 2021: Plastic as a vector of dispersion for marine species with invasive potential. A Review. Front. Ecol. Evol. 9:629756. DOI: 10.3389/fevo.2021.629756 [28] Van Cauwenberghe, L.; Devriese, L.; Galgani, F.; a kol., 2015: Microplastics in sediments: A review of techniques, occurrence and effects. Mar. Environ. Res. 111:5–17. DOI: 10.1016/j.marenvres.2015.06.007 [29] Rochman lab, ©2020-2022: Microplastic Spectral Libraries. Dostupné (pro nekomerční účely) z: https://rochmanlab.wordpress.com/spectral-libraries-for-microplastics-research/
doc. Ing. Lenka Wimmerová, MSc., Ph.D. 1)
Bc. Eva Horáková 1)
Mgr. Martin Lexa, Ph.D. 2)
1) ČZU v Praze
Fakulta životního prostředí
Kamýcká 129
165 00 Praha–Suchdol
wimmerova()fzp.czu.cz
2) ČZU v Praze
Fakulta lesnická a dřevařská
Kamýcká 129
165 00 Praha–Suchdol


